欧亚经济联盟(EAEU)是一个由俄罗斯、白俄罗斯、哈萨克斯坦、亚美尼亚和吉尔吉斯斯坦组成的区域性经济组织。其医疗器械注册制度基于EAEU《医疗器械流通统一原则协定》(2018年生效)及附属技术法规,旨在统一联盟内医疗器械的市场准入标准,确保产品的安全性、有效性和质量。
一、法律框架与核心法规
EAEU医疗器械注册的法律基础主要包括:
- 《欧亚经济联盟条约》及理事会决议;
- 《医疗器械流通统一原则协定》(2021年全面实施);
- 欧亚经济委员会(EEC)制定的技术法规,如对医疗器械分类、注册程序、技术文件、临床评估和上市后监督的具体要求。
二、注册流程概述
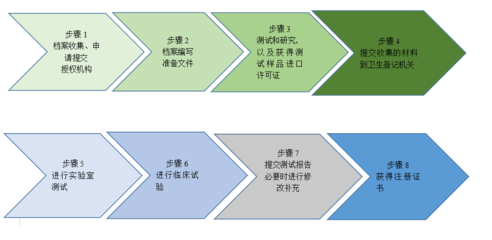
注册流程由EAEU统一管理,申请者需向任一成员国的主管机构(如俄罗斯的Roszdravnadzor)提交申请,通过后注册证书在整个联盟内有效。主要步骤包括:
- 分类确定:根据风险等级(I、IIa、IIb、III类)划分医疗器械;
- 技术文件准备:包括产品描述、技术规格、风险管理文件、临床评估报告和标签信息;
- 测试与评估:可能需要在认可实验室进行性能和安全测试;
- 专家评审:由主管机构或指定机构进行文件审查和现场审核;
- 证书签发:注册有效期为5-10年,可续期。
三、关键法律要求
- 符合性评估:必须符合EAEU统一技术法规,包括安全性和有效性标准;
- 本地代表:非EAEU制造商需指定联盟内的授权代表;
- 标签与语言:产品标签和使用说明需使用俄语及成员国语言;
- 上市后监督:包括不良事件报告、定期安全更新和市场监管。
四、挑战与建议
EAEU注册制度虽简化了多国市场准入,但法规更新频繁,且各国实施细节可能略有差异。企业应及早规划,与本地专家合作,确保合规。总体而言,该制度促进了欧亚区域医疗器械贸易的规范化,为全球制造商提供了重要市场机会。